基態氫原子之最可能半徑及平均半徑的比較(上)
基態氫原子之最可能半徑及平均半徑的比較(上)(The comparison between the most probable radius and the average radius of hydrogen ground state (I))
國立臺灣師範大學化學系兼任教授 邱智宏
高中化學教材論及原子軌域時,總會談到原子半徑,但是原子半徑有許多種不同的定義,例如最可能半徑(the most probable radius)和平均半徑(average radius,或稱為半徑期望值, the expectation value for radius),再者,一般繪製原子軌域時,習慣上將電子出現機率 $$90\%$$ 的範圍含蓋進來,那麼它的半徑和前二者有何關係?
由於學生尚未有量子力學(quantum mechanics)的概念,因此常不知所云,老師也不易交待清楚。另外,原子軌域的大小也常常和化合物中元素的共價半徑(covalent radius)、凡得瓦爾半徑(van der waals radius)等產生混淆。本文試著以氫原子的 $$1s$$ 軌域,說明前述二種半徑的差異,並展示如何經由波函數求出其值,提供冀加深加廣學習的學子,做為補充教材。
一、氫原子的 $$1s$$ 波函數、機率密度分佈函數及徑向分佈函數
由薛丁格方程式(Schrödinger equation)解出的氫原子 $$1s$$ 波函數如下:
$$\displaystyle\varphi_{1s}=\frac{1}{\sqrt{\pi}}\left(\frac{Z}{a_0}\right)^{3/2}e^{-Zr/a_0}$$
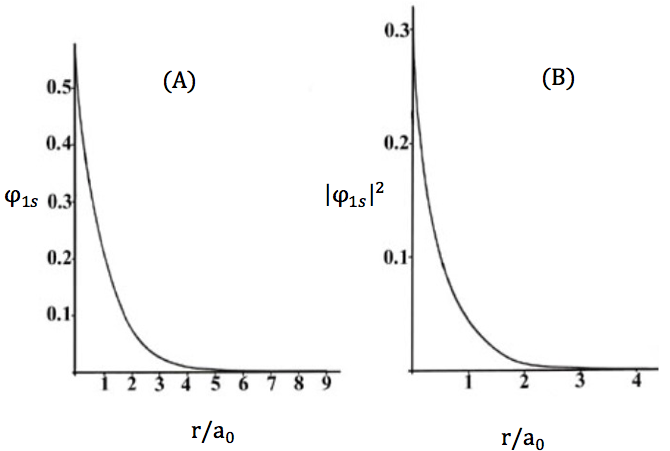
其中 $$a_0$$ 為波耳半徑等於 $$0.53$$ Å,對於氫原子 $$Z=1$$,由於氫原子唯一的一個電子若填在能階最低的 $$1s$$ 軌域上即稱為基態(ground state)。將其波函數對半徑作圖可得圖一(A),其中x座標的刻度為 $$r/a_0$$,由圖中可看出波函數在 $$r=0$$ 最大,隨著 $$r$$ 值的增大,波函數遞減的很快。
電子在各位置出現的機率密度(又稱為電子機率密度,electron probability density)和波函數的平方相關,氫原子單位體積的電子機率密度為:$$|\varphi_{1s}|^2=(\frac{Z^3}{\pi a^3_0})e^{-2Zr/a_0}$$,若將其對 $$r$$ 作圖可得圖一(B),由圖中可看出電子在原子核的地方 $$(r=0)$$ 出現機率最大,隨後快速遞減,其速率比圖一(A)更快,然而這個現象和我們平常的認知不同,電子不可能出現在原子核中,此點可由下列敘述加以解釋。
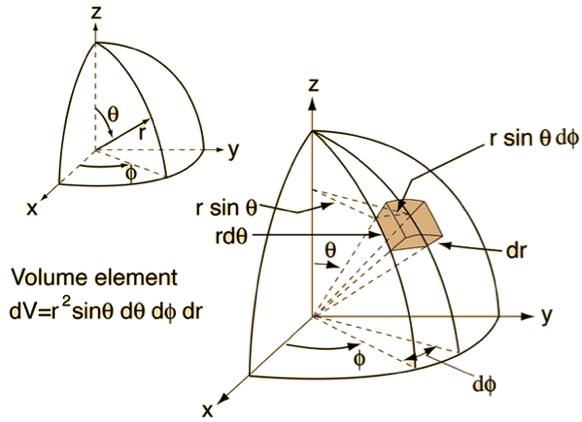
如果我們要詢問距離原子核從 $$r$$ 到 $$r+dr$$,$$\theta$$ 到 $$\theta+d\theta$$,$$\phi$$ 到 $$\phi+d\phi$$ 間的單位體積內找到電子的機率有多大?則必需計算其間體積的變化量再乘上電子機率密度。由圖二可看出極座標單位體積(volume element,$$dV$$)的變化量
$$dV=r\sin\theta~d\phi\times rd\theta\times dr=r^2\sin\theta~d\theta~d\phi~dr$$。
由於 $$1s$$ 軌域的波函數和 $$\theta$$、$$\phi$$ 無關,因此可以單看徑向變化對電子密度的影響如圖三所示,探索從 $$r$$ 到 $$r+dr$$ 間圓殼(spherical shell)內找到電子的機率。
若將 $$dV$$ 乘上機率密度並將 $$\theta$$、$$\phi$$ 積分,便能檢驗徑向變化對電子出現機率的影響:
$$\displaystyle|\varphi_{1s}|^2r^2dr\int^{2\pi}_{0}d\phi\int^{\pi}_{0}\sin\theta~d\theta$$
$$\displaystyle=(\frac{1}{\sqrt{\pi}})^2\left[(\frac{Z}{a_0})^\frac{3}{2}e^{-\frac{Zr}{a_0}}\right]^2r^2dr\times(2\pi-0)\times(-\cos\pi+\cos 0)$$
$$=\displaystyle\frac{1}{\pi}\left[(\frac{Z}{a_0})^{\frac{3}{2}}e^{-\frac{Zr}{a_0}}\right]^2r^2dr\times(2\pi)\times 2=4\left[(\frac{Z}{a_0})^{\frac{3}{2}}e^{-\frac{Zr}{a_0}}\right]^2r^2dr$$
上式中括號內的式子以 $$R(r)$$ 表示,$$[R(r)]^2r^2$$ 稱為徑向分佈函數(radial distribution function),若將其對 $$r$$ 作圖可得圖四,其中x座標的刻度為 $$r/a_0$$。
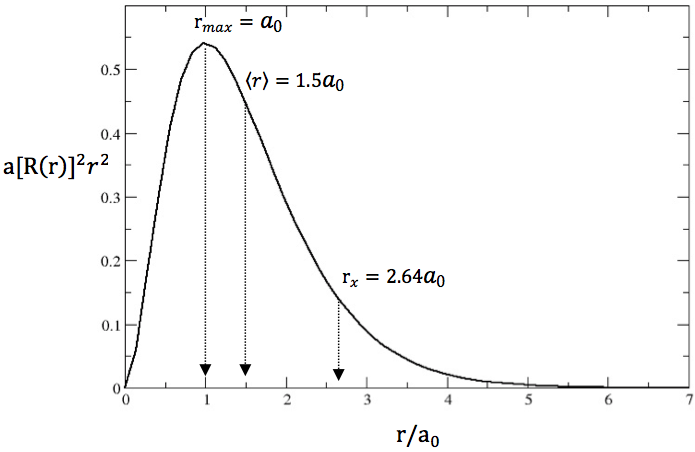
圖四 $$1s$$ 軌域電子出現機率在徑向的分佈圖,圖中 $$r_{max}$$ 及〈$$r$$〉分別標示為最可能半徑及平均半徑的位置,$$r_x$$ 為原子軌域含蓋電子出現機率90%的半徑。(作者繪製)
由圖中可看出雖然在 $$r=0$$ 時的機率密度最大,但是因為 $$r=0$$,$$R(r)r^2=0$$,因此在核內找到電子的機率為 $$0$$ 和實際的情況相符。
由圖中亦可看出在不同圓殼區間找到電子的機率並非均勻分佈,而是呈現不對稱的鐘形分佈,在右邊出現較長的尾巴,代表在離原子核很遠的地方仍有電子出現的機率。
由於圖形中有極大值出現,代表在某特定半徑時,電子出現的機率最大,其值應如何求出?另外,其電子出現機率的平均值應落在那個半徑位置上?一般繪製原子軌域時,習慣上將電子出現機率 $$90\%$$ 的範圍含蓋進來,那麼它的半徑應該多少?這些問題將在下文解答。
參考文獻
- Levine, I. N. (1988), Physical Chemistry (3rd ed.). p622~632, McGRAW-HILL Book Company.
- 葉名倉、劉如熹、邱智宏、周芳妃、陳建華、陳偉民(2013 年)高級中學化學選修上冊。南一書局。第19~33頁。
- Spherical Polar Coordinates — Hyperphysics. http://hyperphysics.phy-astr.gsu.edu/hbase/sphc.html
- Hydrogen: radii of atoms and ions — Webelements. http://www.webelements.com/hydrogen/atom_sizes.html
- slide_44.jpg — CENGAGELeaning. http://images.slideplayer.com/23/6601420/slides/slide_44.jpg


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 中間體與穩定狀態近似法
中間體與穩定狀態近似法  化學傳記:法拉第不為人知的一面(五):兩個演講會
化學傳記:法拉第不為人知的一面(五):兩個演講會  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中 
