電負度( Electronegativity)(二):極性與氫鍵
電負度( Electronegativity)(二):極性與氫鍵
台北縣立三民高級中學化學科林秀蓁老師/國立台灣大學化學系陳藹然博士責任編輯
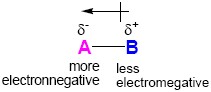
原子和原子之間因作用力結合,能量降低形成化學鍵,根據路易士的鍵結理論,如果形成鍵結的原子為不同元素,其元素電負度不同造成對鍵結電子對的吸引力不同。由於電負度差異,相對於電負度較小的元素,電負度較高的元素對鍵結電子對的吸引力較大,故視電負度較高的元素帶部分負電荷(δ-),電負度較小的元素帶部分正電荷(δ+)。因為分子間的共價鍵之鍵結電子對非均勻分布,所以稱此共價鍵(covalent bond)帶有極性(Polarity),為極性共價鍵(Polar covalent bond)。共價鍵的極性大小和鍵結原子的電負度差有關,電負度差越大,共價鍵的極性愈大,當電負度差超過1.5就變成離子鍵了。極性共價鍵極性的方向為正電荷指向負電荷的方向。
圖一、極性共價鍵
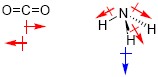
當分子擁有極性共價鍵時就有可能形成具有極性的分子,由於極性具有方向性及大小為一向量(vector),分子的極性為其所有共價鍵極性的向量和;當分子的極性向量和不為零時此分子為極性共價分子(polar covalent molecule)。例如:CO2,雖然C-O為極性共價鍵,但是兩個C-O鍵夾角180度極性向量相互抵消,故CO2分子不具極性;NH3,有三個N-H極性共價鍵,且因分子為三角錐形,三個極性鍵的向量和不為零,故NH3為極性共價分子。
圖二、極性分子鍵與分子極性(紅色危極性鍵,藍色為分子極性)
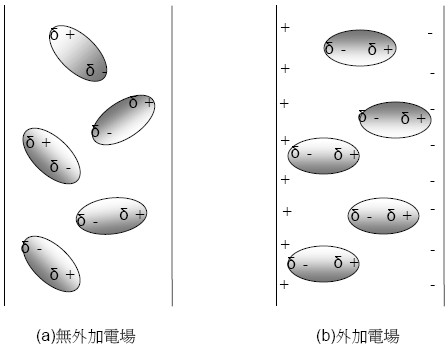
極性共價分子具有較高的分子間作用力,故其沸點與熔點較高,且極性分子在電場受電場效應影響可整齊排列(圖三)。
圖三、外加電場對極性分子之位向效應
某些含氫化合物的分子間引力非常強大;氫與電負度特強之元素,以共價鍵鍵結而具有極高沸點,例如HF、H2O、NH3均較其各族之其它氫化物具有不尋常的高沸點,此分子上的氫與另一電負度特強原子上的非鍵結電子對相吸引,形成較強的分子間引力,稱為氫鍵(hydrogen bond)。除高沸點外,與氫鍵相關化合物亦有較高的熔點、熔化熱、汽化熱及黏度,而在生物體中蛋白質α螺旋、DNA雙螺旋、細胞分裂及合成蛋白質,氫鍵在分子結構上扮演重要的關鍵。
1. 電負度(Electronegativity)(一):鮑林電負度概念、化學鍵之離子性
2. 電負度( Electronegativity)(二):極性與氫鍵
3. 電負度(Electronegativity)(三):溶解度(Solubility)、酸的強度(Acidity)
參考資料:
1. Charles E.Mortimer,吳惠平 譯述,《大學化學》,科技圖書股份有限公司,民國84年。
2. 曾國輝 編著,《原子結構》,建宏出版社,民國84年。
3. 曾國輝 編著,《典型元素》,建宏出版社,民國84年。
4. WIKIPEDIA網站–Electronegativity http://en.wikipedia.org/wiki/Electronegativity
關鍵字:
電負度(electronegativity)、極性(polarity)、極性共價分子(polar covalent molecule)、極性分子靜電場之位向效應、偶極矩(dipole moment)、氫鍵(hydrogen bond)。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  化學傳記:法拉第不為人知的一面(二):從裝訂工變成大學者
化學傳記:法拉第不為人知的一面(二):從裝訂工變成大學者 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  暖暖包的原理
暖暖包的原理  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  中間體與穩定狀態近似法
中間體與穩定狀態近似法 

關於圖二的右手邊的NH3的偶即矩方向是否顛倒邊?因為N的電負度比H高?@@謝謝