水的自解離(Self-ionization)與離子積常數(Ion Product Constant)
水的自解離(Self-ionization)與離子積常數(Ion Product Constant)
國立臺灣大學化學系林雅凡博士/國立臺灣大學化學系李俊毅責任編輯
若上維基百科(Wikipedia)查詢「電解質」的意思,它會告訴你:「電解質是指可以產生自由離子而導電的化合物,通常是指在『溶液』中導電的化合物,但在『熔融態』與『固態』下導電的電解質也存在。」在教科書中,我們學到「純水(即水中一切雜質,包括離子、有機物等都已除去)」是「弱電解質」。所以如果把維基百科的定義套入說明,則「純水」會產生小部分的自由離子,若用很精密的儀器測量,應該測得到它的導電度。
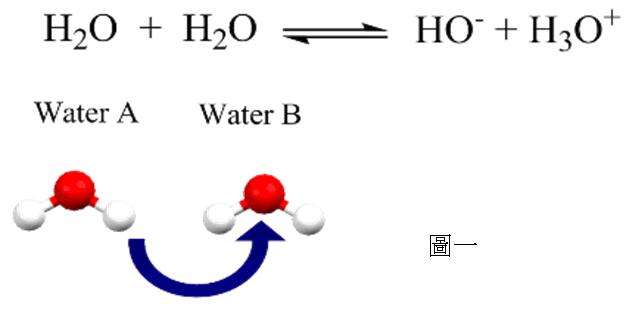
那麼,純水如何產生自由離子呢?如圖一所示,水分子兩兩相互碰撞的時候,水分子B搶奪了水分子A的質子,水分子B得到質子成為H3O+,而水分子A失去質子成為–OH,又因為質量與電荷守恆的原理,水中有多少H3O+,就會有相同數目的–OH,用科學的語言來表達,就是[H3O+“>=[–OH”>,意思是:「純水中,H3O+的濃度與–OH 的濃度相同。」在這樣的反應中,水分子A扮演著「酸」─給予質子的角色;而水分子B則扮演著「鹼」─得到質子的角色。然而純水本身是純物質,水分子A和水分子B在性質上並沒有任何差異,像這樣的酸鹼反應-相同的物種在一個反應中扮演酸,又扮演鹼而產生自由離子的現象,稱作「自解離(self- ionization,或做autoionization)」。水之所以能夠進行自解離,主要是因為水是一個二元性物種(amphoteric),即物種本身既可當酸,又可當鹼,比如: 醋酸溶於水(如式一)的反應中,水扮演著鹼的角色,得到質子,變成H3O+;但是如果將氨溶於水,反應如式二所表達,水分子扮演著酸的角色,給予質子,變成–OH,像這樣既可當酸,又可當鹼的物種,即為二元性物種。二元性物種的特性,使水能進行自解離。
已知道一般狀態下,一杯純水中會含有少許H3O+與–OH,且兩者濃度相同,那麼就有幾個問題值得我們繼續深究下去:
1. 一杯純水中只有少數水分子解離成H3O+與–OH,是因為有些水分子會解離,那這意味有些水分子不會解離嗎?如果是這樣,水分子的化學性質將會分成兩類,又怎麼能說它是純物質?
2. 『少許被解離』是一個很籠統的概念,有沒有更精緻的數值,能幫助我們了解?
第一個問題其實要用「平衡」的觀點去理解。杯水中,所有的水分子都會兩兩相互作用,產生H3O+與–OH,然而產生的H3O+與–OH當然也會互相再結合形成兩當量的水分子。達平衡時,杯水裡有少許的H3O+與–OH及大量中性水分子,所以照理也可以寫成一組平衡常數(式三)
但是水是純物質,[H2O”>為定值,所以只需要考慮[H3O+“>•[–OH”>,而根據實驗的測量,發現在25℃時,純水中,[H3O+“>=[–OH”>=10-7 M,隨著溫度越高,[H3O+“>與[–OH”>越大,因為解離程度越高,但不論任何溫度,純水中,[H3O+“>=[–OH”>的式子永遠成立(可以想想看為什麼?),所以依據實驗數值的結果,可以得到在25℃時,[H3O+“>•[–OH”>= 10-14,這個平衡常數我們以Kw來表達,是為水的離子積常數(ion product constant )。
參考文獻:
1. http://zh.wikipedia.org/zh-hant/%E7%94% … 3%E8%B4%A8
2. Hill, J. W.; Petrucci, R. H.; McCreay, T. W.; Perry, S. S. “General Chemistry” 4th Ed , Pearson Prentice Hall, New Jersey (2005)


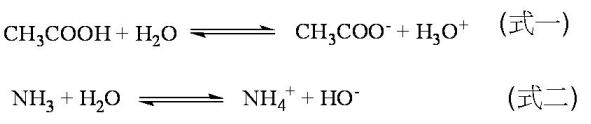
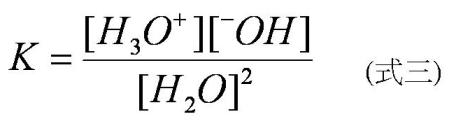
 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性
化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體  強化玻璃
強化玻璃  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  化學的填字遊戲?
化學的填字遊戲?  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法 
