蛋白質摺疊 –上
蛋白質摺疊 (Protein Refolding) –上
國立臺灣大學師範大學生命科學系黃胤榮碩士生/國立臺灣師範大學生命科學系李冠群助理教授責任編輯
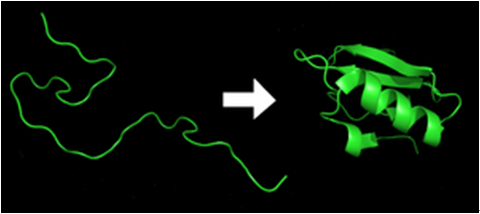
蛋白質摺疊是從任意的多肽鏈摺疊成一個獨特且具有功能性三級結構的物理過程。從一個 mRNA 的序列轉譯成一個線型胺基酸鏈的蛋白質都是以一個未摺疊或是任意的多肽鏈存在。這個多肽鏈缺少任何的三級結構 (圖一)。胺基酸彼此的交互作用摺疊產生一個三級結構的蛋白質,此蛋白質稱為原生 (native) 蛋白質。由此產生的三級結構是由胺基酸序列所決定的 (Anfinsen’s dogma)。
對功能來說,正確的三級結構是不可或缺的,雖然某些部分的功能性蛋白質可能是保持展開的狀態而未摺疊成原生結構,其蛋白質通常是沒有活性且有毒性的。好幾種神經性退化性疾病和其它疾病是被認為由於錯誤的蛋白質摺疊導致類澱粉樣纖維形成並累積。很多導致過敏的原因是與蛋白質的錯誤摺疊有關,對於免疫系統而言,原生結構是不產生特定抗體的蛋白質結構。
蛋白質的胺基酸序列 (或稱一級結構) 是決定原生構形。一個蛋白質分子的自動摺疊通常是在蛋白質合成期間或是之後進行。雖然這些大分子被認為是自己摺疊自己,但過程仍是取決於溶劑 (水或脂質雙層)、鹽的濃度、溫度和是否分子伴侶的存在。
摺疊好的蛋白質通常有疏水性的核心,其緊密的胺基酸側鏈是來穩定摺疊的狀態,而帶電或是極性胺基酸側鏈通常是曝露在蛋白質表面,跟周遭的水做反應。盡可能減少疏水性側鏈的數量曝露在表面, 疏水性作用力是蛋白質摺疊過程中一種很重要的驅動力。分子內氫鍵的形成是另一種可以提供蛋白質穩定的重要貢獻。氫鍵的強度是依據環境來決定的,因此氫鍵籠罩在疏水性核心的貢獻超過氫鍵曝露在水溶性環境更具有穩定蛋白質原生狀態的作用。
蛋白質在細胞內的摺疊過程中通常與轉譯同時進行,所以蛋白質的N端開始摺疊而蛋白質的C端仍然在核醣體在合成。特定的蛋白質稱做分子伴護蛋白 (chaperone),其協助其他蛋白質摺疊。一個研究很透徹的例子就是細菌的GroEL系統,它幫助球狀蛋白質的摺疊。
參考資料:
1. 維基百科:Protein Refolding (http://en.wikipedia.org/wiki/Protein_folding)


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[活動] 全球仿生設計競賽-臺灣校園海選](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/z3.png) [活動] 全球仿生設計競賽-臺灣校園海選
[活動] 全球仿生設計競賽-臺灣校園海選  年齡提高卵母細胞染色體異常機率
年齡提高卵母細胞染色體異常機率 .jpg) 【探索基礎科學系列講座19】翻轉吧,DNA ∞ 雙螺旋65歲生日趴
【探索基礎科學系列講座19】翻轉吧,DNA ∞ 雙螺旋65歲生日趴  負責運動學習的蛋白質
負責運動學習的蛋白質  細胞膜的構造
細胞膜的構造  如何防止自體免疫反應
如何防止自體免疫反應  伊波拉病毒(Ebola virus)—病毒的防制
伊波拉病毒(Ebola virus)—病毒的防制  【2013諾貝爾獎特別報導】生醫獎:破解細胞傳輸系統之謎
【2013諾貝爾獎特別報導】生醫獎:破解細胞傳輸系統之謎 
