學生在化學平衡認知上的迷思概念(上)
學生在化學平衡認知上的迷思概念(上)(Student’s Misconceptions on the Concept of Chemical Equilibrium (I))
國立臺灣師範大學化學系兼任教授 邱智宏
甫教高中生有關化學平衡的章節時,經常碰到幾個觀念學生容易混淆、無法了解,例如可逆性 (reversibility)、反應完成或終結有何差別、平衡是靜態 (static) 或動態 (dynamic)、平衡位置向左或向右移動的意涵…等,這些困擾有些源自於學生先備知識的認知架構,匡限了後學內容的認知了解,有些源自於教學用語的不良溝通,更有些出自没有適當的模型或演示,造成微觀現象的不了解,這些問題不僅在國內的教學現場處處可見,在國外的研究探討也屢見不鮮,詳見參考文獻。本文將以一些實例說明這些迷失概念產生的原因,並藉助一些演示實驗,加以釐清及說明。
一、平衡是反應的終結或完成
國中階段,有關化學反應,老師的教學內容,通常是將反應方程式寫在黑板上,以單一箭頭表示反應朝生成物的方向進行,當有一反應物用罄時,反應就告終結或停止。但後來開始教化學平衡時,則隱含化學反應有可逆性,即反應不只朝一個方向進行,亦即在達成平衡後的反應系統中没有一個物種會被完全用罄,正逆反應仍會持續進行。顯然由於「初學者」尚未有微觀的概念,教師教學時只能藉由巨觀、可觀察的現象來教導學生書寫化學方程式,因而此一概念會持續固著,甚至延伸至開始學習化學平衡,因此巨觀現象没有變化即代表反應已終結的困擾,於焉產生。事實上除了没有微觀概念以外,尚有開放和密閉系統的差異,在開放系統中很難有平衡現象產生。
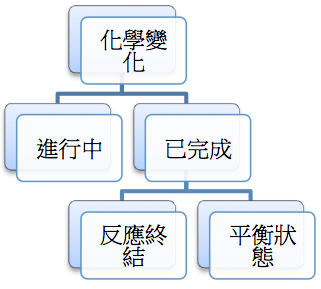
通常化學變化 (chemical transformations) 依照反應進行的時程可區分如圖一,尚在進行中者代表不停有生成物產生,反應尚未終止,巨觀和微觀的現象仍在繼續進行中。化學變化已完成者則有二種情況,其一為反應已終結者,此時不管微觀或巨觀反應均已終止不再進行,若在平衡狀態者,巨觀上雖已無變化,但微觀仍持續進行中。
基於上述迷思,老師開始進行化學平衡的教學時,可藉下列實例及演示實驗加以說明,以建立學生的正確認知,首先以碳酸鈣加熱分解的反應為例:
$$\mathrm{CaCO_{3(s)}}\overset{\Delta}{\rightarrow}CaO_{(s)}+CO_{2(g)}$$ (式— 1)
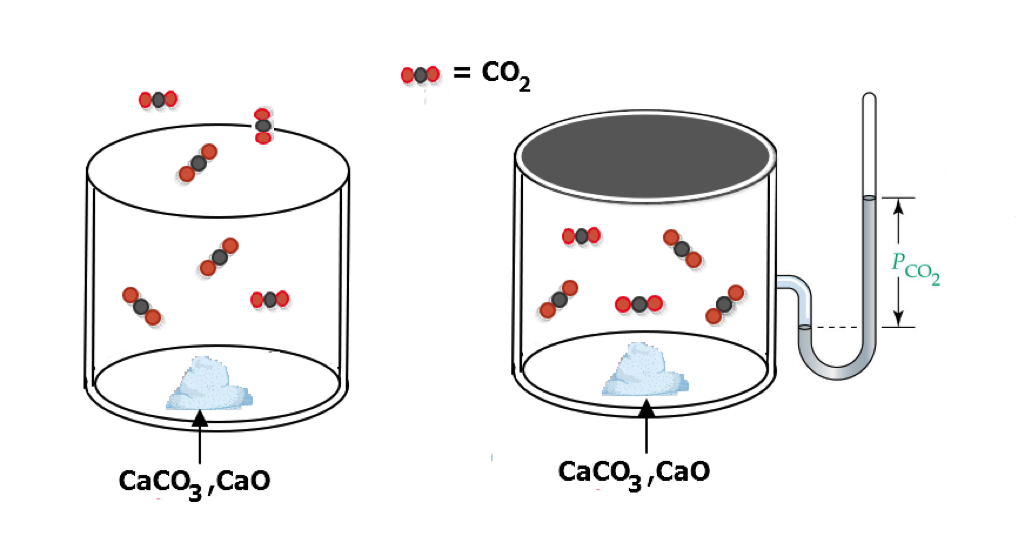
在開口的容器中,定溫加熱碳酸鈣粉末如圖二 (A) 所示,會有二氧化碳生成,容器中反應物的量持續減輕,此時化學變化正在進行,待容器內物質的重量不再變化時,反應即達終結,碳酸鈣已用磬,容器中巨觀和微觀的現象均已無改變,此一認知和學生在國中階段的理解相仿。若同一反應,所有反應條件也一樣,在密閉的定容容器中加熱,則情況迥異。反應進行時,容器內物質的總重量不變,若測量容器內的壓力,則其壓力由原來的大氣壓力持續上升,但到達一特定點時,即為定值不再變化。
經過上述說明後,可提出下列問題,請學生思考:
- 兩者的實驗條件有何重大差異?
- 實驗期間,為何第二個實驗容器內的重量維持不變?而第一個卻是持續減輕?
- 經過精密的檢測,密閉容器中仍有碳酸鈣存在,它不會繼續反應嗎?
- 偵測容器內的壓力,為何達特定值後即不再改變?
學生對於第 1 個問題,大多不會有問題,不是容器有密閉和開口的不同,就是一者有氣體生成物溢洩,一者無。第 2 個問題也大部分答對,閉密系統合乎質量不滅定律,開放系統則有二氧化碳溢散至容器外。但學生開始思考第 3、4 個問題時,便和舊經驗產生衝突,此時學生開始產生疑問,密閉系統中尚有碳酸鈣存在,為何不會繼續反應呢?如果能繼續反應,為何二氧化碳的分壓不再增加?為了解答這個矛盾,此時「反應不只會朝正反應的方向進行,也會朝逆反應的方向進行」的概念,便有可能被誘發出來,如果正逆反應的速率恰好相等時,即碳酸鈣繼續分解,但氧化鈣和二氧化也繼續合成碳酸鈣,因此微觀的反應持續進行,但巨觀的分壓已不再改變,於是上面的疑問便能豁然開朗。這個過程中,可以觀察學生把舊的知識架構重整,將新的概念加以融合,建構出新的知識架構,就如圖一右半部所列,已完成的反應並不只有已終結的反應,還必須含括已平衡的反應。
參考文獻
- Tyson, L., Treagust, D. F., & Bucat, R. B. (1999). The complexity of teaching and learning chemical equilibrium. Chem. Educ, 76(4), 554.
- Bergquist, W., & Heikkinen, H. (1990). Student ideas regarding chemical equilibrium: What written test answers do not reveal. Chem. Educ, 67(12), 1000.
- Van Driel, J. H., Verloop, N., & de Vos, W. (1999). Introducing dynamic equilibrium as an explanatory model. Chem. Educ, 76(4), 559.
- Ghirardi, M., Marchetti, F., Pettinari, C., Regis, A., & Roletto, E. (2013). A teaching sequence for learning the concept of chemical equilibrium in secondary school education. Journal of Chemical Education, 91(1), 59-65.
- Olney, D. J. (1988). Some analogies for teaching rates/equilibrium. Chem. Educ, 65(8), 696.
- Garritz, A. (1997). The painting-sponging analogy for chemical equilibrium. Chem. Educ, 74(5), 544.
- Laurita, W. (1990). Another look at a mechanical model of chemical equilibrium. J. Chem. Educ, 67(7), 598.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第
化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能  中間體與穩定狀態近似法
中間體與穩定狀態近似法 
