溶體之外-談泛素與蛋白質的降解
溶體之外-談泛素與蛋白質的降解 (Degradation)
臺北市立第一女子中學生物科胡苓芝老師/國立臺灣師範大學生命科學系李冠群助理教授責任編輯
細胞中的蛋白質擔任多重角色,如管制物質進出、建構細胞形狀、催化反應和運動等,故無論是蛋白質合成或降解 (degradation,也就是指被分解為小片段),都被精確地調控。有關細胞如何調節蛋白質合成的觀念,在目前高中課程多有論述,如中心法則-轉錄或轉譯的過程;原核和真核細胞基因表現的調節;轉錄因子的表現、活化;轉錄後的修飾或是轉譯前後的調節等。其中較為艱深複雜的內容,在經過適當的補述後,常變身為大學入學考試指定考科的閱讀測驗的取材方向,如97年-「轉譯後的修飾和蛋白質活性」;96年-「RNAi的影響」和94年-「轉錄後或轉譯前RNA的修飾」。
相對地,分解蛋白質的觀念則僅在消化生理或是細胞生理時提到,如溶體會經由膜上的質子幫浦維持膜內的酸性環境,分解並回收外源蛋白質以及衰老或損傷的胞器,故與胞內消化、胞器更新和細胞自戕有關。但無論是消化系統中的蛋白酶或是溶體的水解作用,都無法解釋細胞內如何「選擇性」的消除錯誤或廢棄不用的蛋白質,故本單元即以2004化學諾貝爾獎獲獎主題「死亡之吻-泛素」,簡介細胞另一種蛋白質降解途徑,此主題也曾出現2006 國內生物奧林匹亞競賽(IBO)複試B卷中。
以往細胞中的蛋白質分解大多被認為主要依賴溶體,但研究發現細胞內蛋白質的分解過程直接需要能量,而酸性狀態下溶體蛋白酶分解蛋白質是放熱反應,且不具溶體的未成熟紅血球(reticulocyte)也被證實具有需能性的蛋白質降解作用。學者們遂於80年代根據許多研究結果,發展出一套可以細膩解釋蛋白質降解的途徑:泛素-蛋白酶體系統 (ubiquitin-proteasome system; UPS)。
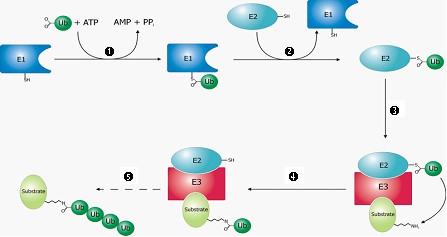
泛素是一種由 76 個胺基酸所組成的小型蛋白質,廣泛存於真核生物和古細菌,故被稱為「ubiquitin」 (源自拉丁文 ubique, everywhere之意)。研究發現在細胞內等待被摧毀的目標蛋白質,會由ATP供給能量,經泛素活化酶(E1)、泛素接合酶(E2)和泛素連接酶(E3)三類酵素先後處理後,將其與泛素鍵結,此一步驟反覆進行,最後目標蛋白質將被接了四個或更多的泛素(圖1),這個短鏈聚泛素分子被諾貝爾頌詞形容為「死亡之吻」。接著,這些被貼上泛素標籤的蛋白質會通過細胞的蛋白酶體,加以分解再循環利用。
聚泛素化是細胞內一種重要的調節過程,經過UPS降解可控制細胞中關鍵信號蛋白和調節蛋白的濃度,同時可以去除過多、受損、折疊錯誤或突變的蛋白質。目前科學家已發現哺乳類細胞含有數種E1、數十種E2以及數百種E3酵素,三類酵素合作,扮演把泛素鍵結到特定蛋白質的角色,尤其是E3酵素的專一性,決定了細胞中要為哪些蛋白質貼上標籤。如果細胞蛋白質的降解出現問題,將會導致疾病,例如人類退化性的神經疾病─帕金森氏症及阿茲海默症的部分成因,便是蛋白質的降解受到阻滯。其它如細胞週期、DNA的修補、抑癌基因(如p53)、細胞凋亡和免疫與發炎反應等,都被發現與此蛋白質降解系統的運作相關。
【想一想】
有學者認為泛素是目前發現演化速度最慢的蛋白質,若此假說為真,你如何解釋?
依照你對生物運作模式的暸解,請推測,聚泛素化後的蛋白質是否有機會死裡逃生呢?
泛素只普遍存於真核生物或古細菌中,那麼真細菌要如何應對蛋白質降解的需求呢?有興趣的同學不妨找找其它資料!
1.經由ATP供給能量,使E1活化泛素(Ub),Ub與E1的cys(半胱胺酸)結合。
2.泛素被轉移到E2。
3.E3可辨認需要摧毀的目標蛋白質(substrate)和E2。
4.經由E2和E3使得泛素轉移到目標蛋白質的lys(離胺酸)上。
5.重複數次,目標蛋白質遂被接上了一短鏈聚泛素。
(圖片來源http://upload.wikimedia.org/wikipedia/commons/7/7f/Ubiquitylation.png)
參考資料
蔡蘊明譯2004年諾貝爾化學獎簡介 台大化學系普化課程資訊
http://www.ch.ntu.edu.tw/course/nobel2004.htm
劉宣良等 200年諾貝爾化學獎-蛋白質的死亡之吻 科學發展(393)60-65, 2005
諾貝爾獎網站有關蛋白酶體的動畫
http://nobelprize.org/nobel_prizes/chemistry/laureates/2004/animation.html

 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講座] [探索基礎科學系列講座16]命孕交響曲的四大樂章](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/09/Sonline.png) [講座] [探索基礎科學系列講座16]命孕交響曲的四大樂章
[講座] [探索基礎科學系列講座16]命孕交響曲的四大樂章  治療乳癌末期新藥 FDA批准上市
治療乳癌末期新藥 FDA批准上市  共軛焦顯微鏡的使用原理
共軛焦顯微鏡的使用原理  【2015諾貝爾生醫獎特別報導】阿弗麥克素及青蒿素-對抗寄生蟲疾病的革命性治療法(三)
【2015諾貝爾生醫獎特別報導】阿弗麥克素及青蒿素-對抗寄生蟲疾病的革命性治療法(三)  使用 CRISPR 技術清除體內的愛滋病病毒
使用 CRISPR 技術清除體內的愛滋病病毒  伊波拉病毒(I)-與死亡共舞
伊波拉病毒(I)-與死亡共舞  悲傷與快樂的音樂引起不同的腦部活化型態
悲傷與快樂的音樂引起不同的腦部活化型態  伊波拉病毒(Ebola virus)—病毒的防制
伊波拉病毒(Ebola virus)—病毒的防制 
